Исследователи из пяти стран сообщили об успехе третьей фазы клинических испытаний перорального пептидного таргетного препарата икотрокинры при обыкновенном псориазе у взрослых и подростков. Отчет об испытаниях опубликован в The New England Journal of Medicine.

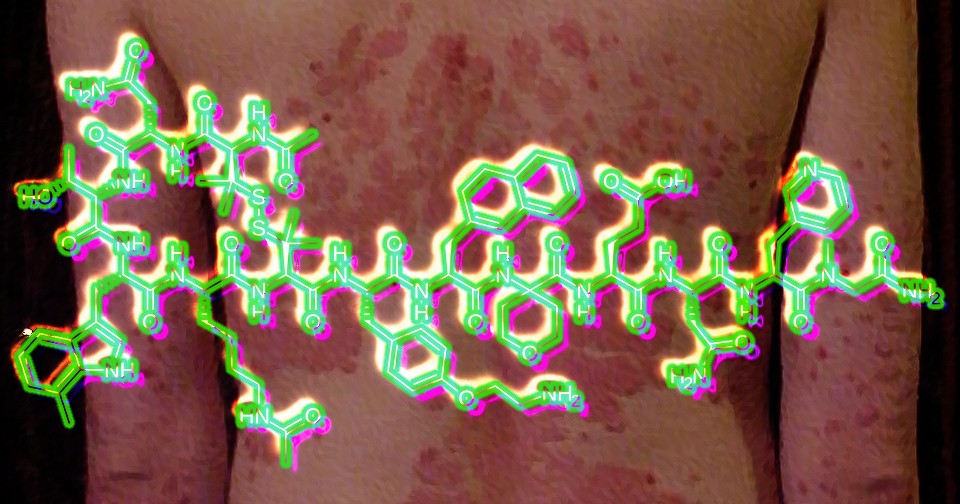
Псориаз представляет собой иммуноопосредованное воспалительное заболевание, которое в 80–90 процентов протекает в простой (бляшковидной) форме с характерными кожными проявлениями. Относительно недавно для его лечения были разработаны новые системные препараты, такие как апремиласт, и более эффективные и безопасные биологические препараты — моноклональные антитела к интерлейкинам-12, -17 и -23, а также ингибитор фактора некроза опухоли этанерцепт. Эти биопрепараты вводятся инъекционно, что может ограничивать сферу и комфортность их применения. Икотрокинра (JNJ-77242113) представляет собой таргетированный пептидный блокатор рецептора к интерлейкину-23, активный при пероральном приеме. В ранних фазах клинических испытаний он существенно облегчал течение псориаза без серьезных побочных эффектов.
Робер Биссоннетт (Robert Bissonnette) из монреальской исследовательской клиники Innovaderm Research с коллегами из Великобритании, Германии, Канады, Китая и США и компанией Johnson & Johnson провел двойные слепые рандомизированные контролируемые испытания третьей фазы ICONIC-LEAD в 138 клиниках 15 стран. В них приняли участие 684 взрослых и подростков с 12 лет с умеренным и тяжелым обыкновенным псориазом (поражение 10 и более процентов поверхности тела, не менее 12 баллов по шкале PASI и не менее трех баллов по шкале IGA). 456 из них назначили икотрокинру по 200 миллиграмм раз в день, остальным 228 — плацебо.
К 16 неделе терапии 90-процентного уменьшения баллов по PASI достигли 50 процентов участников в основной группе против четырех процентов в контрольной, а 0/1 балла по IGA (чистая кожа или небольшие поражения) — 65 против восьми процентов (в обоих случаях p < 0,001). Полное очищение кожи наблюдалось значительно чаще при использовании активного препарата: снижение PASI на 100 процентов у 27 против одного процента, ноль баллов по IGA у 33 против одного процента (в обоих случаях p < 0,001). К 24 неделе в основной группе происходило дальнейшее улучшение: уменьшение PASI на 90 и 100 процентов у 65 и 40 процентов, 0/1 и 0 баллов по IGA у 74 и 46 процентов. Улучшение при приеме икотрокинры по сравнению с плацебо было очевидным уже к четвертой неделе, общие результаты в подгруппе подростков превосходили таковые у взрослых. Хотя бы одно нежелательное явление во время лечения наблюдалось у 49 процентов участников в обеих группах, чаще всего встречались назофарингит и инфекции верхних дыхательных путей.
Полученные результаты свидетельствуют о том, что селективная блокада рецепторов к интерлейкину-23 пероральным пептидным препаратом икотрокинрой эффективно очищает кожу от проявлений обыкновенного псориаза у взрослых и подростков при благоприятном профиле безопасности. В настоящее время ведется долгосрочное наблюдение за участниками для уточнения показателей эффективности и безопасности препарата. Его разработчик Johnson & Johnson уже подал заявки на регистрацию в FDA и EMA.
Проведенные ранее клинические испытания показали, что разработанный для лечения обыкновенного псориаза крем с агонистом арилуглеводородных Аh-рецепторов тапинарофом эффективен также при атопическом дерматите у взрослых и детей с двух лет.